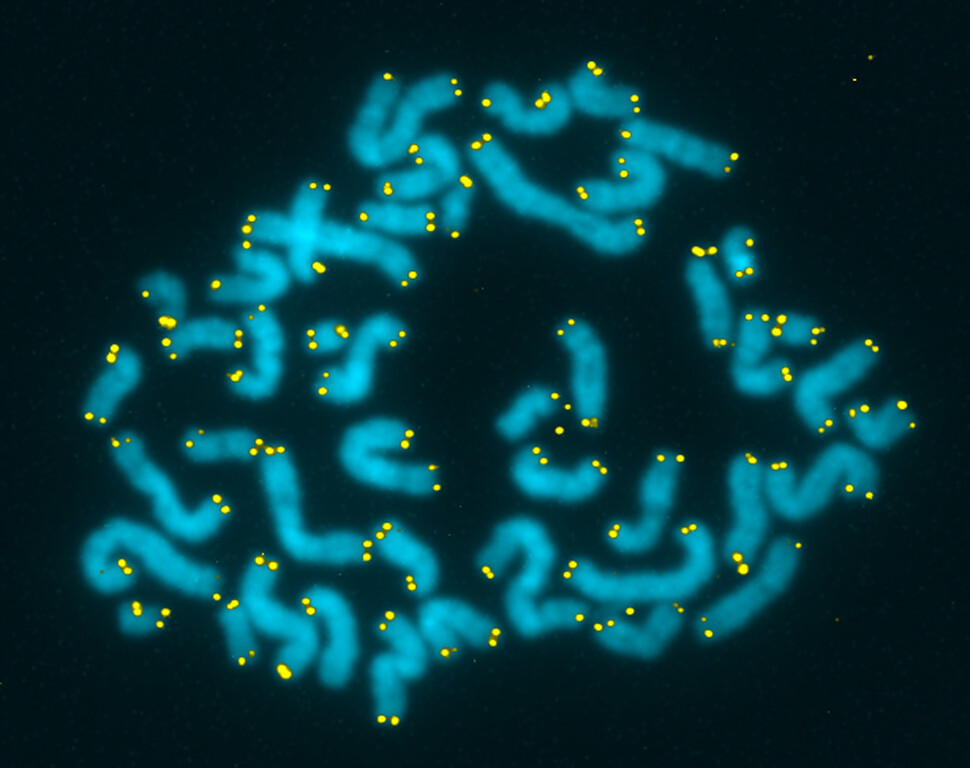
DNA 조각 끝에 길게 붙은 텔로미어는 유전정보가 잘려나가는 걸 막는 일종의 보호막이다. 한겨레
글 쓰는 일이 직업이다보니 손가락은 제 몸에서 많이 사용하는 부위 중 하나가 됐지요. 그런데 어느 날 문득, 키보드를 두드리는 손가락에서 자잘한 흉터들이 눈에 띄더군요. 언제 생겼는지 모를 작은 흉터들을 보면서 서글픈 생각이 들었습니다. 어린 시절, 수없이 넘어지고 까지고 베었습니다. 하지만 그 상처가 흉터가 되어 남는 경우는 거의 없었습니다. 무릎을 부딪쳐 손바닥만큼 딱지가 생겨도 그게 떨어지고 나면 어느새 다시 예전 피부로 돌아왔는데, 요즘에는 작은 상처가 나도 잘 아물지 않을뿐더러 흉터로 남는 일이 많아졌습니다. 그러다보니 나이 들면서 “몸이 예전 같지 않아”라는 말을 더 자주 쓰게 되죠.
실제 피부에 상처가 나면 염증(Inflammation), 증식(Proliferation), 상피화(Epithelialization), 재형성(Remodeling) 과정을 거쳐 재건이 이뤄지는데, 보통 초기 염증 반응이 2~4일 지속된 뒤 2~3주 동안 세포가 증식해 상처로 잃은 부분이 메워집니다. 하지만 노인이 되면 초기 염증 반응 기간이 7~14일까지 늘어나고, 피부 증식 역시 원래보다 5~6주 정도 지연됩니다. 그래서 노인이 상처 입은 곳에 3개월 내에 상처를 또 입으면 영구적인 피부 손상이나 흉터가 생길 가능성이 커집니다. 어린 시절에는 그토록 빨랐던 세포재생 주기가 이렇게 늘어지는 건, 세포도 함께 늙어가기 때문일까요?
우리 몸의 기본단위는 세포입니다. 사람에 따라 조금씩 다르겠지만 우리 몸은 200여 종에 이르는 약 37조 개의 세포로 구성됐습니다. 사람의 평균수명은 80여 년인데 대개 세포 수명은 그보다 훨씬 짧아 수일, 수년에 불과합니다. 외부 물질에 직접 닿고 소화액에 노출되는 위장관 내부의 상피세포와 외부 침입자를 걸러내 공격하는 호중구(백혈구의 일종으로, 사람의 백혈구에서 가장 많은 비율을 차지합니다)는 수명이 짧아서 3~5일에 그칩니다. 우리 몸을 구성하는 세포 수의 85%가량을 차지하는 적혈구는 약 4개월, 우리 몸을 둘러싼 피부세포는 약 4주 주기로 기존 세포는 죽고 새 세포로 교체됩니다.
교체 주기가 긴 세포도 있습니다. 간세포는 12~18개월, 머리카락의 모낭세포는 2~10년, 뼈세포는 10년 정도의 주기로 교체됩니다. 평균적으로 매일 우리 몸 전체 세포 수의 1%에 조금 못 미치는 3300억 개의 세포가 죽는다는 결과가 나옵니다. 세포 종류에 따라 차이가 있지만, 인체를 구성하는 대부분 세포는 인간 자체의 수명보다 짧습니다. 세포 교체 주기가 사람 수명보다 훨씬 짧은데도 우리 몸이 비슷하게 유지된다면, 죽는 세포만큼 새로운 세포가 추가돼야 합니다. 이 새로운 세포는 언제까지 공급될까요?
20세기 초반에는 생체 구성 세포가 무한정 증식해 계속 공급된다고 생각했습니다. 획기적인 혈관봉합술을 개발해 노벨생리·의학상을 받은 의사 알렉시 카렐(1873~1944)은, 세포는 무한 증식이 가능한데 현실에서 이런 일이 일어나지 않는 것은 환경 탓이라고 주장합니다. 세포는 영원불멸의 가능성을 가지고 태어나지만 환경이 이를 꺾어버린다는 것이죠. 실제로 카렐은 닭의 심장에서 추출한 섬유아세포를 무려 34년간이나 배양했다고 주장했는데, 이는 닭의 평균수명인 5~10년보다 월등히 긴 시간입니다.
이런 믿음이 깨진 때는 1961년입니다. 당시 미국 샌프란시스코 캘리포니아대학(UCSF) 의대 해부학과 교수이던 레너드 헤이플릭(1928~)은 카렐의 주장에 따라 사람의 섬유아세포를 배양하는 과정에서 세포분열 횟수가 늘어날수록 분열에 걸리는 시간이 점점 길어지며 종국에 더는 분열하지 않고 죽어버리는 현상을 관찰합니다. 카렐의 주장과 반대되는 것이었죠.
헤이플릭은 자신의 관찰이 잘못된 배양법 때문이 아니라, 애초 세포에서 자연스럽게 일어나는 현상임을 확실히 증명하고자 숙련된 세포유전학자인 폴 무어헤드에게 도움을 청합니다. 무어헤드는 색다른 세포배양법을 고안합니다. 서로 다른 개체에서 얻은 같은 종류의 세포를 섞어서 배양했죠. 그는 쉽게 구별하기 위해 남성과 여성에게서 유래한 섬유아세포를 사용했습니다. 남성 세포와 여성 세포는 성염색체의 구성(남성 XY, 여성 XX)이 다르므로 쉽게 구별할 수 있으니까요. 무어헤드는 남성의 섬유아세포는 40번 이상 분열한 것으로, 여성의 섬유아세포는 20회 이하로 분열한 것을 준비해 이를 하나의 배양접시에 섞어 배양합니다. 같이 배양하기에 이들에게 주어진 환경조건은 동일합니다. 다만 기존에 분열했던 횟수에만 차이가 있죠.
시간이 지나자 배양접시에는 먼저 남성의 섬유아세포가 모두 사멸해서 사라지고 여성의 것만 남았습니다(물론 시간이 더 지나자 여성의 섬유아세포도 모두 사멸했습니다). 동일한 환경에 놓였음에도, 이전에 더 많이 분열했던 세포가 먼저 사라졌다는 것은 카렐이 아닌 헤이플릭의 관찰이 옳았음을 뜻합니다. 배양을 잘못한 것이 아니라 원래부터 세포에 수명이 정해졌다는 것이죠. 이후 사람을 비롯한 척추동물의 세포분열 횟수에는 한계가 있고, 이것이 개체의 전체적 수명 제한에 영향을 주리라는 ‘헤이플릭 한계’(Hayflick Limit)가 생물학계의 상식이 됩니다. 그렇다면 카렐의 실험은 어떻게 된 것일까요? 그가 조작했을까요?
당시 헤이플릭과 무어헤드는 사람 세포가 무한정 증식하지 못한다는 사실을 알았지만, 왜 이런 현상이 일어나는지 알지 못했습니다. 이 비밀이 밝혀진 건, 1984년 오스트레일리아 출신 미국인 분자유전학자 엘리자베스 블랙번(1948~)에 의해서입니다. 블랙번은 염색체 말단에 있는 텔로미어(Telomere)의 존재를 찾아낸 인물입니다. 사람을 비롯해 진핵세포 생명체의 염색체는 양 끝이 노출된 기다란 실 형태인데, 복제할 때마다 끝부분을 약간씩 잃습니다. 마치 옷을 오래 입으면 소맷귀가 해지는 것처럼 염색체 끝부분도 조금씩 떨어져 나갑니다. 그래서 셔츠를 만들 때 소맷귀는 몸판에 비해 두껍고 튼튼한 소재를 사용하듯이, 사람의 염색체 끝부분에도 이렇게 닳는 것을 대비해 별다른 의미가 없는 DNA 조각이 길게 붙어 있습니다. 그것이 바로 텔로미어죠.
텔로미어는 염색체 양 끝에 있어 염색체 내부의 유전정보가 잘려나가지 않게 막아주는 일종의 보호막 구실을 합니다. 하지만 세포분열이 거듭되고 염색체 복제가 여러 번 일어나면 텔로미어의 길이는 점점 짧아지고 결국 닳아서 사라지는 시기가 옵니다. 텔로미어의 길이가 일정 수준 이하로 짧아지면, 세포는 분열을 멈추고 세포 사멸 프로그램을 돌립니다. 그래서 텔로미어 길이는 자연적인 세포분열의 중단과 세포 사멸을 일으키는 주요 원인이 되지요.
그렇다면 의문이 생깁니다. 텔로미어 길이가 짧아지는 것이 세포분열의 한계가 된다면, 텔로미어 길이를 늘이거나 유지한다면 세포는 무한정 증식이 가능하지 않을까요? 네, 맞습니다. 텔로미어를 재건하는 효소 텔로머라제(Telomerase)의 도움을 받으면 세포는 무한정 증식이 가능합니다. 우리 몸에는 대표적으로 생식세포가 텔로머라제를 자연적으로 가지고 있으며, 때로 일반 세포도 돌연변이를 일으켜 텔로머라제를 만들어냅니다. 그러니 앞서 카렐의 실험에서, 닭의 섬유아세포에서 돌연변이가 일어나 텔로머라제를 만들 수 있었다면 닭의 수명보다 훨씬 길게 분열하는 것도 가능합니다.
사람의 경우에도 1951년 헨리에타 랙스라는 여성의 몸에서 채취한 세포가 헬라세포(HeLa cell)라는 이름을 얻어, 지금까지 70년 넘도록 전세계 많은 생물학 실험실에서 배양용 세포로 이용되고 있습니다. 처음에는 겨우 몇g에도 미치지 못했던 헬라세포는 현재 전세계에 약 20억t이 넘는 양이 배양될 정도로 어마어마하게 불어났고, 앞으로도 계속 분열될 예정입니다.
이처럼 텔로머라제가 세포 사멸을 방지한다면, 세포에 텔로머라제를 처리해주면 노화를 막을 수 있지 않을까요? 그런데 문제가 있습니다. 세포 중에 텔로머라제를 스스로 만들어내도록 변이를 일으킨 세포는 십중팔구 치명적인 암세포가 된다는 것입니다. 세포 사멸을 막기 위해 암을 키워봤자 개체의 생존에는 도움이 되지 않습니다. 대부분의 세포에 정해진 수명 한계가 존재하는 것은, 텔로미어가 짧아지기 때문이기도 하지만, 여러 번 분열해 복제된 세포일수록 복제 오류가 일어날 가능성이 크고 복제 오류가 누적되면 돌연변이가 생길 수도 있기 때문에, 자체적인 세포 사멸 시스템으로 이를 방지하는 것이기도 합니다. 이렇게 본다면, 세포의 일생은 탄생해 정해진 죽음을 향해 달려가는, 인간의 숙명과도 닮았습니다. 인간의 운명에서 가장 확실한 것은 그가 언젠가는 죽으리라는 사실이니까요.
과학자들은 세포분열을 유심히 관찰하다가 흥미로운 현상을 관찰합니다. 누구나 태어나서 죽음을 맞이하는 건 동일하지만, 죽음에 이르는 과정에서 ‘노화’라는 현상이 일어납니다. 세포에서도 동일한 현상이 일어나는 것을 관찰했죠. 세포분열을 거듭할수록 배양접시에는 생명활동이나 분열활동이 매우 느려져 일종의 ‘정지’ 상태에 들어가는 세포가 늘어납니다. 이런 세포는 내부에 노폐물이 쌓여 원래보다 크기가 커지고 전체적인 모양도 탄력을 잃고 납작해지는 현상이 나타납니다. 과학자들은 이런 현상에 ‘세포노화’(Cellular Senescence)라는 이름을 붙이고, 이런 특징을 보이는 세포를 노화세포라 명명합니다. 흥미로운 사실은, 노화세포는 오히려 세포 사멸에 저항성이 있어 평균적인 세포의 수명보다 더 길게 산다는 것입니다. 노화세포가 일반 세포보다 수명이 길다? 이는 노화 연구를 하는 이들에게 또 다른 도전거리가 됐습니다.
이은희 과학커뮤니케이터
한겨레21 인기기사
한겨레 인기기사

국방부, 장군 아닌 첫 국방보좌관 임명 나흘만에 업무배제

‘이재명 대선후보 자격 박탈’ 향해 초스피드 질주한 조희대 코트

SK하이닉스 15.5%↓ 삼성전자 14.1%↓…애프터마켓서 하락폭 커져

법원노조 “조희대 사퇴하라…국민의 정치적 선택권 뺏으려해”

이 대통령 분당 아파트 팔리나…홍익표 “사겠다는 사람 나와”

조희대, 거취 압박에 사퇴 거부…“헌법 부과한 사명 다하겠다”
![가슴 치며 ‘검은 연기’ 보지 않으려면…어떻게 할 것인가 [아침햇발] 가슴 치며 ‘검은 연기’ 보지 않으려면…어떻게 할 것인가 [아침햇발]](https://flexible.img.hani.co.kr/flexible/normal/500/300/imgdb/child/2026/0303/53_17725196285494_20260303502471.jpg)
가슴 치며 ‘검은 연기’ 보지 않으려면…어떻게 할 것인가 [아침햇발]

‘체급’ 다른 이란…통제 불능 장기전도 부담, 미 지상군 투입 회의적

‘이란 공습’에 장동혁 “김정은의 미래” 박지원 “철렁해도 자신감”
![악마화하지 마라 [그림판] 악마화하지 마라 [그림판]](https://flexible.img.hani.co.kr/flexible/normal/500/300/imgdb/original/2026/0303/20260303503624.jpg)
악마화하지 마라 [그림판]










![회춘한 늙은 쥐의 비밀 [늙음의 과학]](https://flexible.img.hani.co.kr/flexible/normal/212/127/imgdb/child/2022/1021/53_16663380957915_9416663380862233.jpg)





